Bisphénol A
| Bisphénol A | ||
| ||
 | ||
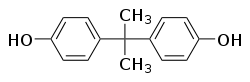
| Structure du bisphénol A | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 4,4'-dihydroxy-2,2-diphénylpropane | |
| Synonymes |
BPA, |
|
| No CAS | ||
| No ECHA | 100.001.133 | |
| No CE | 201-245-8 | |
| PubChem | 6623 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs[1] | |
| Propriétés chimiques | ||
| Formule | C15H16O2 [Isomères] |
|
| Masse molaire[2] | 228,286 3 ± 0,013 7 g/mol C 78,92 %, H 7,06 %, O 14,02 %, |
|
| Propriétés physiques | ||
| T° fusion | 152 à 153 °C[1] | |
| T° ébullition | 360 °C[3] ; 250 à 252 °C (1,7 kPa)[1] |
|
| Solubilité | 300 mg·l-1 (eau)[3] ; sol. dans l'acide acétique, les sol. aq. alcalines, l'alcool, l'acétone. Légèrement sol. dans CCl4 |
|
| Masse volumique | 1,2 g·cm-3[1] | |
| T° d'auto-inflammation | 600 °C[1] | |
| Point d’éclair | 207 °C (coupelle ouverte)[1] | |
| Pression de vapeur saturante | à 190 °C : 87 Pa[1] | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| SGH[5] | ||
| H317, H318, H335 et H361f |
||
| SIMDUT[6] | ||
 D2A, D2B, |
||
| Écotoxicologie | ||
| LogP | 3,32[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le bisphénol A (BPA) est un composé organique de la famille des aromatiques, utilisé principalement dans la fabrication de plastiques et de résines. Obtenue par réaction entre deux équivalents de phénol et un équivalent d'acétone, sa molécule comporte deux groupements fonctionnels phénol. Il est aussi dénommé 4,4'-(propan-2-ylidène)diphénol ou p, p'-isopropylidènebisphénol.
Son écotoxicité a été débattue, mais en juin 2017, après que le Canada l'eut classé comme reprotoxique, le comité des États-membres de l'Agence européenne des produits chimiques (AEPC) a classé à l'unanimité le bisphénol A parmi les « substances extrêmement préoccupantes » du règlement REACh, en tant que perturbateur endocrinien[7],[8].
Chez l'animal, il affecte l'immunité[9] et a des effets transgénérationnels démontrés, même à de très faibles niveaux d'exposition in utero[10], avec chez la souris un effet comportemental pouvant être lié à l'inhibition de deux hormones, la vasopressine et l'ocytocine, observé sur 4 générations.
Comme le nonylphénol, c'est un perturbateur endocrinien œstrogéno-mimétique[11] capable de se lier, entre autres, aux récepteurs α et β des œstrogènes[12]. Son action serait environ 1 000 fois inférieure à celle de l’estradiol, mais il est très présent dans notre environnement —environ trois millions de tonnes de BPA sont produites chaque année dans le monde[13], quatre millions de tonnes en 2015 selon PlasticsEurope, l'association professionnelle des producteurs de plastique européens[14]— et dans le corps humain.
Il est notamment utilisé comme monomère de résines époxyde (des polyépoxydes tapissent l'intérieur de certaines boites de conserve et canettes, les principales sources d'exposition pour l'homme) et de polycarbonates. Il a aussi beaucoup servi de révélateur dans l’impression thermique (présent sous forme libre dans un grand nombre de tickets de caisse et reçus de carte de crédit imprimés sur papier thermique). On en trouve aussi dans les billets de banque.
Autrefois très présent dans le plastique des biberons, il est interdit pour raisons de sécurité sanitaire au Canada le 17 octobre 2008[15], puis le en France, après proposition du Sénat en mars 2010 dans le cadre du projet de loi Grenelle II[16],[17].
Le 19 mai 2011, le Sénat de Belgique propose de l'interdire dans les tickets de caisse et les reçus de carte de crédit[18]. Le 1er janvier 2013, le bisphénol A est interdit en Belgique pour les contenants alimentaires destinés aux enfants en bas âge[19].
Le Sénat français vote son interdiction à partir du 1er juillet 2015 dans tous les contenants alimentaires. Le Sénat vote également l'interdiction non seulement du bisphénol A mais plus généralement de tous les perturbateurs endocriniens et substances cancérogènes pour les dispositifs médicaux destinés aux bébés et femmes enceintes[20],[21]. Dans la version définitive de la loi, la date d’interdiction est avancée au 1er janvier 2015, mais la disposition sur les dispositifs médicaux est limitée au bisphénol A dans les biberons et au DEHP dans les tubulures[22]. La disposition sur les contenants alimentaires sera partiellement censurée en 2015 par le Conseil constitutionnel, à la suite d'un recours de PlasticsEurope[23],[14]. En 2016, une enquête révèle que certaines canettes et boites de conserve contiennent encore du bisphénol A, illégalement[24].
Il est souvent remplacé par le bisphénol B ou le bisphénol S, tous deux aussi nocifs sinon plus[25],[26],[27],[28],[29].
Histoire[modifier | modifier le code]
La première synthèse chimique du bisphénol A serait due à Alexandre Dianine, chimiste russe, en 1891.
Il a été très étudié dans les années 1930 lors de recherche d'œstrogènes synthétiques, mais n'a jamais été utilisé comme tel du fait de la découverte à la même époque du diéthylstilbestrol aux propriétés jugées plus intéressantes.
En 1960 débute son utilisation massive par l'industrie du plastique, notamment sous forme de polycarbonate.
Dans les années 2000, certaines agences sanitaires s'inquiètent peu à peu de son utilisation[30],[31], et la réglementation se durcit progressivement[15],[22]. En 2017, le bisphénol A est reconnu par l'Agence européenne des produits chimiques (AEPC) comme perturbateur endocrinien « extrêmement préoccupant »[8] ; il est interdit en France dès 2015, malgré un recours au Conseil constitutionnel puis à la Cour de justice de l'Union européenne du lobby du plastique[32].
Ces évolutions réglementaires semblent marquer le début d'un programme d'élimination et de remplacement de cette molécule:
- les effets du BPA sur l'homme continueront d'être étudiés ;
- la production sera réduite ;
- de nouveaux produits seront mis à l'essai pour remplacer cette substance dans tous les produits de consommation.
Toutefois, les principales alternatives sont de la même famille chimique : le bisphénol S (déjà utilisé par l'industrie à hauteur de 10 000 à 100 000 tonnes par an rien qu'en Europe, et suspecté d'avoir des effets aussi délétères que son cousin) et le bisphénol B (déjà classé comme « substance extrêmement préoccupante », et massivement utilisé dans des pays non européens mais qui exportent vers l'Europe)[32].
Utilisations[modifier | modifier le code]


Le bisphénol A est principalement utilisé comme monomère pour la fabrication industrielle par polymérisation de matières plastiques en poly(carbonate de bisphénol A) (PC) et de résines époxyde. Les polycarbonates sont très utilisés dans des produits de consommation courants, des lunettes de soleil et CD aux récipients pour l'eau et la nourriture. En France, en 2008, ils étaient encore présents dans 90 % des biberons[33].
C'est aussi un antioxydant dans les plastifiants et dans le PVC, ainsi qu'un inhibiteur de polymérisation dans le PVC.
Certains de ces plastiques peuvent être repérés par le chiffre 3 (PVC), 7 (autres) ou PC (polycarbonate) au centre ou en dessous du symbole de recyclage (voir Code d'identification des résines).
Dans les années 1990 et au début des années 2000, il est fréquent sous forme libre dans un grand nombre de tickets de caisse (papier thermique), qui tendent ensuite à être remplacés.
Certains monomères entrant dans la composition des résines composites d'obturation utilisées pour les soins dentaires sont partiellement constitués de bisphénol A : il s'agit du bis-GMA (diméthacrylate glycidique de bisphénol A), du bis-EMA (diméthacrylate d'oxyde éthylène de bisphénol A) et du bis-DMA (diméthacrylate de bisphénol A)[34]. Parmi eux, les deux composants les plus courants, le bis-GMA et le bis-EMA, de par leurs liaisons éther, ne sont pas hydrolysés et ne libèrent donc pas de bisphénol A. Seul le bis-DMA montre des signes d'hydrolyse et de libération de bisphénol A. En revanche, aucune résine composite ne contient directement de bisphénol A.
Enfin, les résines contenant du bisphénol A sont très utilisées comme revêtement intérieur des boites de conserve[35].
Réglementation[modifier | modifier le code]
Évolution de la réglementation[modifier | modifier le code]
- Le , Environnement Canada et Santé Canada proposent de classer le bisphénol A au rang de substance toxique au titre de la Loi canadienne de protection de l'environnement[36],[37]. À la suite de cette proposition, le bisphénol A, très présent dans le plastique des biberons en polycarbonate, est interdit pour raisons de sécurité sanitaire au Canada le 18 octobre 2008[38],[15]. Le Canada devient ainsi le premier pays à classer au rang des toxiques cette substance, ce qui va amener les États-Unis et l'Union européenne à se prononcer à leur tour. Le produit sera ensuite interdit dans certaines villes et États américains (Chicago, Minnesota, Connecticut et comté de Suffolk (New York)[39]).
- La Food and Drug Administration (FDA) des États-Unis avait en 2008 initialement déclaré le BPA sans danger. Elle est revenue sur son avis, sur la base de nouvelles études concluant à « des effets potentiels sur le cerveau et sur la prostate des bébés et des fœtus ». La FDA a ensuite encouragé l'initiative des industriels américains de ne plus utiliser de BPA dans les contenants d'aliments pour bébés[40] et souhaite que le BPA ne soit plus utilisé dans les revêtements intérieurs de boîtes de conserve[41].
- Le , le BPA est interdit en France dans les biberons après proposition du Sénat en mars 2010 dans le cadre du projet de loi Grenelle II[16],[17].
- Aux États-Unis, dans le courant de l'année 2010, les sénateurs Dianne Feinstein (dém., Californie), Charles E. Schumer (dém., N.Y.) et le représentant Ed Markey (dém., Massachusetts) déposent une proposition de loi visant à son interdiction pour tout contenant de boisson[39].
- En janvier 2011, la Commission européenne adopte la directive UE no 8/2011, interdisant l’utilisation du BPA dans les biberons pour nourrissons en polycarbonate, à compter du 1er mars 2011[42]. Il reste autorisé pour les autres matériaux en contact avec les denrées alimentaires moyennant le respect de la norme de 2006.
- Le 19 mai 2011, le Sénat de Belgique propose d'interdire le BPA dans les tickets de caisse et les reçus de carte de crédit[18].
- Courant 2011, un projet de loi est déposé par le député (PS) Gérard Bapt, visant l'interdiction du bisphénol A dans les contenants alimentaires avant 2014[10].
- En octobre 2012, le Sénat français vote son interdiction à partir du 1er juillet 2015 dans tous les contenants alimentaires. Le Sénat vote également l'interdiction non seulement du bisphénol A mais plus généralement de tous les perturbateurs endocriniens et substances cancérogènes pour les dispositifs médicaux destinés aux bébés et femmes enceintes[20],[21].
- En décembre 2012, la loi est adoptée dans sa forme définitive. Le bisphénol A est interdit à compter du 1er janvier 2013 dans les conditionnements à usage alimentaire destinés aux enfants de 0 à 3 ans, et sera interdit pour tous les conditionnements alimentaires au 1er janvier 2015[43],[22]. La disposition sur les dispositifs médicaux est limitée au bisphénol A dans les biberons et au DEHP dans les tubulures[22].
- Le 1er janvier 2013, le bisphénol A est interdit en Belgique pour les contenants alimentaires destinés aux enfants en bas âge[19].
- Le 1er janvier 2015, la loi interdisant son utilisation en France pour tout contenant alimentaire entre en vigueur[22].
- En 2015, l’interdiction française du BPA pour les contenants alimentaires est partiellement censurée par le Conseil constitutionnel, à la suite d'un recours de PlasticsEurope[23],[14].
- En 2016, une enquête révèle que certaines canettes et boites de conserve contiennent encore du bisphénol A, illégalement[24].
- Courant 2016, dans le cadre du Règlement REACh, l'Agence européenne des produits chimiques (AEPC) augmente le niveau de toxicité associé au bisphénol A : il est d'abord classé en catégorie 1B (« présumé toxique pour la reproduction ») le 16 juillet[44], puis est classé comme « substance extrêmement préoccupante » pour ses propriétés reprotoxiques le 19 décembre[45]. Cette classification oblige désormais les industriels à demander une autorisation (temporaire et renouvelable) pour l'utiliser[8], à signaler à l'AEPC sa présence dans les articles fabriqués et importés, et à informer les acquéreurs[8].
- Le 12 décembre 2016, la Commission Européenne publie un nouveau règlement concernant l'utilisation du BPA dans le papier thermique. Selon ce nouveau règlement, le papier thermique contenant du bisphénol A sera définitivement interdit à partir du 2 janvier 2020[46].
- Le 16 juin 2017, le bisphénol A est classé par l'AEPC comme « substance extrêmement préoccupante », dans le cadre du Règlement REACh, pour ses propriétés de perturbateur endocrinien[8].
- La directive européenne 2020/2184 du 16 décembre 2020 impose aux États membres, à partir du 2 janvier 2026, de fournir une eau potable respectant des valeurs maximum concernant le bisphénol A (2,5 µg/L), les chlorates, les chlorites, les acides haloacétiques, la microcystine-LR, le total des PFAS (0,50 µg/L), la somme des PFAS (0,10 µg/L) et l’uranium[47]. Les fournisseurs d'eau doivent également vérifier les concentrations de ces substances à partir de la même date[47].
- En avril 2023, l'Autorité européenne de sécurité des aliments (EFSA) réévalue la sécurité du bisphénol A sur la base des nouvelles preuves scientifiques. Elle établit l'apport quotidien tolérable à 0,2 ng par jour et par kilogramme de poids corporel, soit environ 20 000 fois moins que sa précédente préconisation, en 2015[48].
Recours contre la loi française de décembre 2012[modifier | modifier le code]
En France, après que le bisphénol A ait été interdit dans les biberons en 2010[17], une loi plus générale est adoptée le 24 décembre 2012 qui prévoit « la suspension de la fabrication, de l'importation, de l'exportation et de la mise sur le marché de tout conditionnement, contenant ou ustensile comportant du bisphénol A et destiné à entrer en contact direct avec des denrées alimentaires ». Cette loi précise que le Gouvernement, après avis de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail pourrait autoriser « la reprise de ces opérations »[49],[22].
Mais PlasticsEurope (lobby des grands fabricants européens de matières plastiques) a attaqué la loi au nom de la « liberté d'entreprendre », la jugeant non conforme aux droits et libertés tels que garantis en France par la Constitution, en déposant une question prioritaire de constitutionnalité (QPC) devant le Conseil d'État et le Conseil constitutionnel[23].
En audience, l'avocat de PlasticsEurope[14] a affirmé qu'une interdiction, même provisoire isolerait le marché français, désorganiserait la chaîne de valeur de l’industrie du plastique et de l’emballage plastique, et serait source d'un manque à gagner, d'un risque de délocalisation et de perte d’emplois et de compétitivité pour l'industrie du plastique ; ajoutant que le principe de précaution ne peut être évoqué pour la santé, et que le bisphénol A ne pose pas de problèmes d'environnement[14].
Pour le représentant du Gouvernement, la mesure était proportionnée car provisoire et réversible (en lien avec les avancées de la connaissance), ne touchant que les plastiques et vernis de contact alimentaire, et car des doutes significatifs existent encore sur l’innocuité de ce produit quand il est en contact avec des aliments notamment pour certaines catégories de la population qu'on ne saurait autrement protéger d'une exposition à ce produit[14].
Après avoir écouté les parties et délibéré, le Conseil d'État a rendu son avis le 17 septembre 2015. Il « a en partie accueilli le grief fondé sur la liberté d'entreprendre », reconnaissant une certaine atteinte au principe d'entreprendre, mais sans la juger « manifestement disproportionnée au regard de l'objectif de protection de la santé qu'il a poursuivi » [50]. Le Conseil constitutionnel a, « en revanche, relevé que la commercialisation des produits en cause est autorisée dans de nombreux pays et qu'ainsi la suspension de la fabrication et de l'exportation de ces produits sur le territoire de la République ou à partir de ce territoire est sans effet sur la commercialisation de ces produits dans les pays étrangers. Le Conseil constitutionnel en a déduit que la suspension de la fabrication et de l'exportation de ces produits en France ou depuis la France apporte à la liberté d'entreprendre des restrictions qui ne sont pas en lien avec l'objectif poursuivi »[50] et juge que dans ce cas, si le législateur pouvait interdire l'importation et de la mise sur le marché national, il ne pouvait interdire en France la fabrication pour l'exportation[50].
Réaction des fabricants aux interdictions[modifier | modifier le code]
À la suite des différentes interdictions de l'utilisation du bisphénol A et aux craintes des consommateurs, différents fabricants l'ont remplacé par d'autres produits, comme le bisphénol B ou le bisphénol S, et vantent désormais l'absence de bisphénol A, sans préciser la plupart du temps son remplaçant potentiellement plus nocif[51]. Pour les boîtes de conserve et les canettes par exemple, en plus du bisphénol A toujours autorisé dans l'Union européenne, les bisphénols F et S notamment le sont également[52].
Au Japon, les fabricants ont réduit de façon volontaire leur utilisation du bisphénol A dans les emballages entre 1998 et 2003. Pour ce faire, ils ont remplacé les résines époxy par un film en PET comme fabriqué par la société Toyo Seikan ou par des résines époxy ayant une migration beaucoup plus faible de bisphénol A dans la nourriture[53].
Le fabricant de boîtes de conserves et canettes Ball Corporation propose à nouveau des boîtes de conserve avec un revêtement en oléorésine, qui était utilisée autrefois avant son remplacement par le bisphénol A moins cher[54]. Ce type de revêtement augmenterait le coût des boîtes de 14 %, ce qui reviendrait à une augmentation du prix de vente de 3 à 5 centimes par boîte de haricot[55]. Un inconvénient de cette oléorésine est qu'elle ne résiste pas aux aliments acides, comme la tomate[55].
Le PET et l'oléorésine semblent être les meilleures alternatives au bisphénol A pour les emballages[56]. Les bocaux en verre, les sachets souples de type Doypack et les emballages de type Tetra Pak (revêtus de PET) sont également des alternatives[56].
Environnement et santé[modifier | modifier le code]
Dispersion et omniprésence dans l'environnement urbain[modifier | modifier le code]
Dans les années 2010, des alkylphénols (AP) et du bisphénol A (BPA) sont retrouvés dans toutes les eaux de ruissellement urbaines. Ils proviennent notamment de la pollution routière (usure des pneus qui en contiennent) et urbaine (lessivage de matériaux utilisés dans le bâti et pour les infrastructures urbaines[57].
Après la pluie les lixiviats de divers des matériaux de construction, peintures et plastifiants et des matières et consommables largement utilisés par l'industrie automobiles contiennent et diffusent des AP, alkylphénols éthoxylés et BPA dans l'eau de ruissellement[57].
Une étude récente (2017) a exposé 36 échantillons de matériaux (neufs et usagés, classés dans sept grandes familles de matériaux de construction : PVC, béton, polycarbonate, bitume modifié SBS, matériaux de drainage) et deux matériaux automobiles (carrosserie, pneumatiques) à des tests de lixiviation au méthanol puis pour certains d’entre eux, à des tests de lixiviation par de l’eau ; en complément trois fluides (liquide de frein, lave-glace et liquide de refroidissement) ont aussi été analysés[57]. Résultats : les composés recherchés étaient bien extractible à l'eau et omniprésents dans les matériaux urbains modernes. Les taux d’émission les plus élevés concernaient le BPA et le nonylphénol (NP)[57]. Pour le BPA, ce sont le polycarbonate, les pneumatiques, certaines carrosseries de voiture et les PVC qui en relarguent le plus de (10 à 300 ng/g). Pour le NP (lixivié dans l'eau à hauteur de 1 à 10 ng/g) ce sont les PVC, certains bétons, les bitumes modifiés SBS et les échantillons de carrosserie qui en étaient les principales sources[57]. Les pneus étaient la seule source importante d'octylphénol (OP) (1 à 10 ng/g). Du BPA (0,3 à 5,5 g/L) et du NP (2,3 à 2,9 mg/L) étaient aussi présents dans les liquides de frein. Et des traces d'AP et de BPA ont été trouvées dans les liquides de refroidissement et de lave-glace[57].
Exposition chez l’homme[modifier | modifier le code]
« Le BPA est connu pour s'extraire des plastiques spontanément à très faible dose et plus significativement s'il est nettoyé avec des détergents puissants ou utilisé pour contenir des acides, ou des liquides à hautes températures »[58].
La contamination humaine se fait essentiellement par ingestion, mais un passage par les voies respiratoires ou la peau est possible. Il s'accumule ensuite dans les tissus adipeux.
95 % des échantillons d’urine d'adultes américains contenaient du BPA à dose quantifiable[59].
Au Canada, il était détecté chez 91 % des Canadiens de 6 à 79 ans selon Santé Canada, à raison en moyenne de 1,16 µg/l d'urine, soit un taux proche de ceux relevés (concentrations moyennes ou médianes) ailleurs allant de 1 à 3 μg/l. Au Canada toujours, les 12-19 ans sont plus touchés (1,5 µg/l en moyenne), alors que les taux les plus faibles sont détectés chez les plus de 60 ans (0,9 µg/l en moyenne). D'autres études ont donné des résultats similaires : 93 % des urines contiennent du BPA à faible niveau, mais aussi davantage de glucuronide de BPA, qui est le sous-produit de métabolisation, excrété en quelques jours. En Allemagne, le BPA est couramment retrouvé dans l’organisme d’une large majorité de la population, quel que soit l’âge, et notamment chez les enfants[60]. Selon l'Anses il serait en France d'environ 1 µg/l.
Le risque induit par cette exposition est controversé, car les concentrations mesurées correspondent à des expositions 1 000 fois inférieures à la réglementation EPA/US[61], mais produisent néanmoins des effets avérés chez les rongeurs. Or les rongeurs semblent moins bien métaboliser le BPA et y être de l'ordre de dix fois plus sensibles[62]. Les nourrissons sont les sujets les plus à risque (leur exposition pouvant être douze fois plus élevée que celle des adultes[réf. nécessaire]). L'exposition moyenne d'un adulte en France, en 2012, est de 0,04 μg/kg[63], tandis que celle des nouveau-nés est estimée à des valeurs comprises entre 0,2 et 2 μg/kg[64].
En 2010, des travaux démontrent que le bisphénol A utilisé pour enduire sous forme libre les papiers d’impression thermique (en moyenne 13,3 g BPA/kg de papier), et notamment présent dans un grand nombre de reçus de caisse pénètre l'organisme humain par la peau, notamment quand elle est humide[65],[66]. Les taux résiduels de BPA étaient les plus importants dans l'organisme d'hôte(sse)s de caisse[67], et la manipulation 10 h/jour de tickets de caisse pourrait correspondre au passage percutané de 71 μg de BPA[65]. Du BPA est encore trouvé adsorbé sur l'épiderme après un lavage des mains, même soigneux[65].
Effets environnementaux connus ou suspectés[modifier | modifier le code]
Le bisphénol A est massivement utilisé par l'industrie des plastiques. Parce que la liaison ester des polymères à base de BPA est facilement hydrolysable, du BPA a été largement disséminé dans l'environnement depuis plusieurs décennies où il a conduit à une exposition généralisée de la population humaine[68]. Or c'est un xénoestrogène stable et résistant, un leurre hormonal, capable de « mimer » l’effet des hormones sexuelles féminines, qui jouent un rôle dans la fonction de reproduction mais aussi dans le développement d’organes comme le cerveau ou le système cardio-vasculaire[69].
On en trouve maintenant dans presque tous les organismes vivants. Ainsi Park et Choi ont établi le EC50 du BPA à 0,2 mg l−1 et à 3,3 mg l−1 le LC50 pour les larves aquatiques Chironomus tentans[70].
Le consensus écotoxicologique est que le bisphénol A est écotoxique au-delà de certaines doses qui varient selon les groupes et les espèces, par des mécanismes qui pourraient être différents de ceux des autres xénoestrogènes[71]. Des études, notamment faites de 2003 à 2008 sous l'égide de l'Union européenne, ont porté sur les effets du BPA sur divers taxons aquatiques (poissons et mollusques), semi-aquatiques (amphibiens) et terrestres (reptiles, crustacés, insectes, vers de terre, oiseaux et plantes[71]). Les animaux les plus étudiés sont les poissons, pour lesquels les valeurs de toxicité aiguë du BPA varient entre 1 et 20 mg·l-1 chez les vertébrés et invertébrés. Chez les poissons, les concentrations létales 50 mesurées entre 48 et 96 heures sont comprises entre 4,6 et 17,9 mg·l-1 (voir Tableau XVI de l'étude Anses 2011[71] citée en notes de bas de page).
Effets sanitaires connus ou suspectés[modifier | modifier le code]
Le degré de toxicité et d'écotoxicité du bisphénol A, et secondairement sa dose journalière admissible, sont encore discutés[72], et ont surtout été étudiés chez le rat de laboratoire, pour ses effets sur le cerveau[73], sur la reproduction des mâles[74]. À hautes doses, ses risques sur la santé humaine sont considérés comme probables[75],[76].
Une association de médecins, l'Association Santé Environnement France (ASEF), a alerté l'opinion publique sur les dangers du BPA présent dans les biberons[77]. Depuis, l'Assemblée nationale a voté le 23 juin 2010 l'interdiction du BPA pour les biberons[17]. Fin 2012, à la suite d'un rapport de l'ANSES[78] sur la toxicité du BPA, elle a voté une proposition de loi[79],[22] interdisant le BPA dans tous les contenants alimentaires destinés aux bébés dès 2013 et début 2015 pour les autres : boîtes de conserve, emballages plastiques, canettes, etc.
Le bisphénol A (BPA) est ubiquitaire dans l'eau potable au robinet, et ses dérivés chlorés (Clx-BPA) sont suspectés d’avoir une action de perturbateur endocrinien 100 fois supérieure[80]. Or le chlore est un désinfectant fréquent de l'eau du robinet[81],[82] et de piscines. Des BPA chlorés Clx-BPA peuvent être dosés dans l'eau mais aussi dans l'organisme (dans l'urine[83] et plus difficilement dans les tissus adipeux[84]). Une étude (2015) de faisabilité d’une recherche d’exposition hydrique au BPA et aux Clx-BPA dans un groupe de patientes opérées du sein en a trouvé des doses élevées dans les graisses du sein de patientes victimes de cancer du sein, mais une étude avec un nombre d'échantillons et un protocole plus précis est nécessaire pour évaluer d'éventuelles relations de cause à effet[80].
Effets systémiques possibles[modifier | modifier le code]
- Des études ont montré (sans que d'éventuels liens de causalité directe soient déjà identifiés et compris) qu'un taux urinaire élevé de ce produit était corrélé avec un risque plus élevé
- - de diabète de type 2 (point encore discuté[85]),
- - de maladies cardio-vasculaires[86],
- - d'anomalies du bilan hépatique[87],
- - ces affections étant aussi induites par une alimentation déséquilibrée, certains scientifiques jugent que le BPA pourrait être un marqueur de mauvaise alimentation[88] et non la cause de ces maladies ; Plus on consomme de graisses et de sucres, plus on risque de consommer du BPA et plus on risque de développer ces maladies.
- - d'altération de l'émail dentaire en cas d'exposition précoce (démontré[89] chez le jeune rat exposé à de faibles doses journalières de BPA ; avec des effets qui évoquent une pathologie de l’émail récemment observée chez 18 % environ des enfants de 6 à 8 ans ; dite MIH (pour Molar Incisor Hypomineralization) et qui n'affecte que les premières molaires et incisives permanentes, qui deviennent hypersensibles à la douleur et plus vulnérables aux caries[90]).
- effets sur le sein : cancérogénicité ; les données disponibles sont récentes (post-2000) et en évolution, avec une seule étude épidémiologique chez l'homme, qui a des limites méthodologiques selon l'Anses. Chez l'animal, des effets avérés sont une accélération de la maturation de la glande mammaire à l'âge adulte après exposition prénatale ou périnatale au BPA[71] et des lésions hyperplasiques intracanalaires (si exposition périnatale ou prénatale), ou des lésions de type néoplasique dites CIS ou carcinomes intracanalaires (si exposition périnatale au BPA). Un risque accru de tumeurs mammaires est suspecté (en cas de co-expositions avec un agent cancérogène) s'il y a eu exposition prénatale ou périnatale au BPA[71]. In vitro, le bisphénol A réduit l'efficacité des chimiothérapies pour le cancer du sein sur des cultures cellulaires, « à des concentrations de BPA (1 and 10 nM[91]) comparables à celles trouvées dans la population générale » [92], selon les auteurs « apparemment en modifiant l'expression de protéines impliquées dans l'apoptose, ou mort cellulaire programmée », cet effet ayant été observé quel que soit le produit anticancéreux utilisé dans l'expérimentation (cisplatine, vinblastine ou autres agents chimiothérapeutiques) ;
- parmi les effets attendus et mieux compris : en tant que perturbateur hormonal[93], il s'est montré capable d'affecter la reproduction d'animaux de laboratoire et des preuves scientifiques le désignent comme l'un des facteurs de délétion de la spermatogenèse et d'altération de la santé reproductive chez l'Homme[94] ;
- chez le lapin, à faible dose (1 picogramme), il peut inhiber l'érection du pénis à la suite de modifications des tissus du corps caverneux. Plus la dose de BPA est importante, plus les tissus sont dégradés par augmentation de collagène fibreux, dépôts de graisse, hyperplasie et fibrose[95] ;
- la souris de laboratoire CD1, exposée in utero à de faibles doses de BPA, accouche de mâles présentant une prostate plus lourde et un épididyme diminué, alors que les femelles présenteront des altérations du développement des glandes mammaires[96] ;
- 10 μg·kg-1 par jour induisent chez la souris des anomalies de développement de la prostate fœtale (ce qui rend plausible un risque accru de cancer ultérieur[97]) ;
- effets sur le système reproducteur mâle : selon l'ANSES[71] les conclusions épidémiologiques diffèrent (mais sur la base d'études ayant porté sur des échantillonnages différents (hommes féconds et inféconds). Par contre, le BA est facteur reconnu de délétion de la spermatogenèse après 5 semaines d'exposition au BPA chez l'animal selon deux études aux résultats convergents[98],[99]. Les conséquences d'une exposition prénatale, néonatale et post-natale (lactation) sont encore controversées chez l'animal. Pour la période pubertaire, on suspecte une moindre production de testostérone et modification de l’activité sexuelle[71] ;
- effets sur le système reproducteur femelle (dont sur l'endomètre, les ovaires polykystiques ou comme facteur de fausses couches et prématurité).
- En 2011, l'Ansees[71] appelait à des études complémentaires car les preuves étaient selon l'Agence encore méthodologiquement limitées (faible échantillonnage au sein de la population, participants choisis, manque d'analyse statistique fine, etc. dans un contexte de confusions possibles, ne permettent pas de conclure avec certitude d'un effet délétère pour la femme.
- En 2014, une étude visant à mettre à jour les preuves expérimentales de reprotoxicité du BPA a conclu que d'après le modèle animal et le modèle in vitro le BPA est clairement un « toxique de l'ovaire » en ce qu'il affecter le début de la méiose (dans le modèles animal comme in vitro)[94], il interfère avec la rupture du nid de cellules germinales (dans des modèles animaux)[94], il accélère la transition du follicule (démontré chez plusieurs espèces animales)[94], il modifie la stéroïdogenèse chez la femelle dans chez plusieurs espèces animales testées[94], et il diminue la qualité des ovocytes en limitant la maturation ovocytaire dans plusieurs modèles animaux[94](ainsi que chez les femmes subissant une fécondation in vitro selon 2 études publiées respectivement en 2010 et 2011[100],[101] la seconde présentant selon l'ANSES des limites méthodologiques, mais « non majeures ».
Plusieurs conséquences sont confirmées ou « avérées chez l’animal » en exposition prénatale, comme post-natale :
- - augmentation de la survenue de kyste des ovaires[71],
- - modifications hyperplasiques de l'endomètre,
- - puberté avancée (pour une exposition pré- et post-natale précoce).
Plusieurs études d'exposition in utero ou post-natale précoce ont montré (effet avéré) une perturbation hormonale hypothalamo-hypophysaire gonadotrope avec variations des taux d’hormones sexuelles, perturbation de l'expression des récepteurs des hormones sexuelles.
Chez l’animal adulte, des effets sont observés (dont remaniement histologique de la paroi utérine, changement morphologique du tractus génital), mais à des doses bien supérieures au NOAEL retenue par l'AESA[71] ; En 2014, « les données sont encore insuffisantes concernant les effets du BPA sur l'oviducte, le placenta, et le développement pubertaire »[94].
- effets sur le cerveau et le comportement : des effets sont suspectés sur la neurogenèse, le « dimorphisme sexuel comportemental », l'anxiété, le comportement exploratoire et chez l'animal, sur une altération du comportement maternel. Ils ne peuvent être démontrés chez l'être humain faute de données, mais plusieurs études sur l'animal ont montré un effet sur le développement neurologique en cas d'exposition in utero ou périnatale. Des anomalies de neurodifférenciation et des systèmes aminergique et glutamatergique NMDA sont observés[71]. Le BPA affecte aussi dans ce cas les récepteurs œstrogènes (ERα et ERß), et le nombre de neurones sensibles à l'ocytocine et à la sérotonine. Dans le cerveau, l'hypothalamus (et en son sein des régions impliquées dans le dimorphisme sexuel) semble le plus affecté. Dans l'hippocampe (lié aux activités cognitives et à l'anxiété), les zones associées aux récepteurs NMDA sont également modifiées. Ces résultats sont néanmoins controversés car des études réalisées avec des niveaux d'exposition différents, concluant selon les cas, à un non-effet[102], un effet anxiogène chez la jeune souris exposée[103] ou toujours chez la souris, à un effet anxiolytique associé à un déficit cognitif en cas d'exposition in utero[104], différences qui pourraient aussi être lié au caractère "hormonal" de ce perturbateur ;
- effets sur le métabolisme lipidique, glucidique et le système cardio-vasculaire : ils sont suspectés chez l'Homme à la suite d'une étude transversale (Melzer et al., 2010) ayant mis en évidence une corrélation entre problèmes cardio-vasculaires (coronariens et diabète) et teneurs urinaires en BPA[71].
L'exposition de rongeurs au BPA (in utero ou chez l'adulte) affecte le métabolisme du foie, des tissus adipeux et du pancréas, avec selon certains auteurs des « changements dans l'expression des gènes codant des protéines intervenant dans les voies de signalisation cellulaire impliquées dans la lipogenèse et le métabolisme glucidique »[71]. In vivo, la lipogenèse semble affectée, de même qu'in vitro. Des effets sur le métabolisme des glucides ont été signalés à la suite d'une exposition prénatale et périnatale au BPA, mais avec une mauvaise répétabilité des expériences (cet effet reste donc controversé). Par contre, chez l'animal toujours, le BPA, in vivo et in vitro augmente - de manière avérée - la lipémie et le risque de surcharge pondérale en activant la lipogenèse, avec un effet avéré de l'exposition prénatale et périnatale ou chez l’adulte[71] ; - effets thyroïdiens : chez les amphibiens, in vitro, la métamorphose se montre affectée - de manière avérée - selon l'Anses par le BPA qui est alors antagoniste des hormones thyroïdiennes, probablement en augmentant le recrutement de corépresseurs des récepteurs des HT, mais les autres données disponibles en 2010 ne permettent ni de confirmer ni d'infirmer un tel rôle chez l'Homme ou les mammifères (aux doses auxquelles nous sommes exposés)[71].
Les rongeurs, en laboratoire présentent un effet du BPA sur le fonctionnement thyroïdien quand l'exposition se fait durant la maturation finale de l'axe hypothalamo-hypophyso-thyroïdien[71] ; - effets sur le système immunitaire. Le BPA est un sensibilisant cutané de catégorie B[105],[71], associé à une production d'anticorps anti-cytomégalovirus, mais sans que l'on puisse, à ce jour, évaluer l'importance de cette réaction ou ses conséquences immunitaires. Le BPA suscite chez l'animal une production de lymphocytes T et une surproduction avérée de cytokines, avec un déplacement de la réponse immunitaire observée en faveur des Th2, sans que l'on puisse extrapoler de conséquences pour l'Homme[71] ;
- effets sur l'intestin : en 2010, ils ne semblaient pas avoir jamais été étudiés chez l'être humain, mais l'animal adulte exposé à de fortes doses de BPA y réagit comme avec l'estradiol, probablement via une action sur les récepteurs aux estrogènes[71]. Le BPA a eu chez des animaux nés de mères traitées, un effet pro-inflammatoire dans la descendance femelle (évoquant un manque de maturation du système immunitaire). Le BPA pourrait avoir un effet d'inflammation de l'intestin et modifier la perméabilité intestinale (effet suspecté, sur la base d'une seule étude chez l’animal)[71] ;
- effets sur le testicule et la prostate (développement et cancérogénicité) : Après une longue période de doute, plusieurs études récentes (2014) ont confirmé que le BPA est aussi un « toxique testiculaire », dans le modèle animal et chez l'Homme[94]. De même pour ses effets sur la prostate, car jusqu'alors d'éventuels effets prostatiques n'avaient pas été épidémiologiquement vraiment étudiés chez l'Homme ou avec un faible nombre de patients (ex : sur 60 patients traités en urologie, le taux de BPA urinaire (créatinine ajustée) était significativement plus élevé chez ceux des patients atteints d'un cancer de la prostate, avec une corrélation encore plus marquée chez les moins de 65 ans). Une revue d'étude en 2007[106] puis une étude de 2008 avaient déjà conclu qu'une exposition au Bisphénol A (à des « doses pharmacologiques » et in utero en période critique de développement de la prostate pouvait altérer l'épigénome de la prostate et augmenter dans le futur (chez l'adulte) sa susceptibilité à la carcinogenèse[107], de même ensuite pour une exposition à faibles dose (à des doses « environnementales »[107]).
Par contre « les études animales ont montré que le BPA contribue au développement du cancer de la prostate », in vitro notamment, et semble-t-il en générant des « anomalies du centrosome » qui seraient le « mécanisme sous-jacent » (un phénomène de nucléation des microtubules a aussi été observée. Et l'exposition de lignées de cellules de prostate à de faibles doses (0,01 à 100 nM) de BPA a augmenté très significativement (de deux à huit fois) le taux de cellules touchées par des anomalies du centrosome[108],[109].
On avait déjà montré que chez les rongeurs l'exposition in utero ou à une période précoce de la vie au bisphénol A (BPA) « reprogramme la prostate et accroit sa sensibilité à la carcinogenèse hormonale avec le vieillissement » [109],[110], même si (chez les murins) sur plusieurs générations (de souris et rats), le poids de la prostate ne semble pas affecté[111],[112] par le BPA chez l'adulte ; Le poids de la prostate augmente néanmoins, (et avec des hyperplasies détectées dans les cas où des coupes histologiques ont été faites)[113] s'il y a eu exposition prénatale chez la souris[114]. L'exposition néonatale (rongeurs) a produit des lésions de type PIN, mais pas d'adénocarcinome de la prostate[71].
En 2011, l'ANSES considérait encore que les effets sur la prostate, suspectés chez l'animal, étaient encore controversés chez l'homme[71] ; Des chercheurs ont alors utilisé des cultures de cellules souches épithéliales de prostate humaines provenant de jeunes donneurs exempts de maladie. Ils ont constaté qu'in vitro « comme avec l'estradiol-17β (E2), le BPA augmentait l'auto-renouvellement des cellules souches progénitrices[109], ainsi que l'expression de gènes liés à ces cellules avec une relation dose-dépendante »[109]. Des cellules souches prostatiques saines ont ensuite été greffées sur des reins de souris vivantes (qui ont développé un tissu prostatique normal en un mois), pour tester in vivo l'effet d'une exposition au BPA. Ce BPA a été administré par voie orale, à raison de 100 ou 250 µg de BPA/kg de poids corporel [109]. L'incidence de phénomènes de néoplasie intra-épithéliale du tissu prostatique et d'adénocarcinomes a alors nettement augmenté, passant de 13 % chez les souris-témoins (ayant reçu du pétrole au lieu de BPA) à 33 % à 36 % au sein des greffes exposées in vivo au BPA (P <0,05)[109]. Les auteurs ont conclu que in vitro comme in vivo, le BPA « cible » effectivement les cellules progénitrice prostatiques et « peut contribuer, à faibles doses, à augmenter le risque de cancer hormono-dépendant dans l'épithélium de la prostate humaine »[109]. Une altération de l'épigénome des cellules prostatiques exposées in utero, déjà détectée par une étude de 2008[107], puis par deux études en 2012[115],[116] a été confirmée par une nouvelle étude en 2014 [117]. Toutes ces études plaident pour une cause précoce du cancer de la prostate et montrent que le Bisphénol A peut être l'une des causes de ce cancer[116].
Sur ces bases, en mars 2014 dans la revue Endocrinology deux endocrinologues (JM Lobaccaro et A Trousson) alertent sur le fait que l'exposition in utero au BPA est une « bombe à retardement » pour les futurs cancers de la prostate[118].
Risques in utero[modifier | modifier le code]
Le placenta ne protège pas l'embryon de l'exposition au bisphénol A. Un passage transplacentaire significatif du BPA (4 % d’une dose de 20 μg·kg-1 donnée à la mère) est avéré chez la souris[119]. Chez l'humain, il augmente le poids du bébé à la naissance[120]. L'INSERM a publié en 2010 une expertise collective sur ses effets[121]. Il n'aurait pas d'effets neurologiques sur le développement[122].
Risques durant l'allaitement et l'enfance[modifier | modifier le code]
Avec la diffusion de cette molécule, à la fin du XXe siècle, que ce soit via une alimentation classique ou via l'allaitement, le bébé puis le jeune enfant ont été de plus en plus exposés au bisphénol A. Au début des années 2000, le lait maternel en contient des quantités significatives[123] et il peut combiner ses effets avec d'autres polluants contenus dans les aliments ou dans le lait maternel, dont les phtalates[124] ou d'autres polluants organiques persistants[125]. Le lait maternel reste néanmoins recommandé en termes de bénéfice global pour la santé de l'enfant.
Historique et évolution de la connaissance[modifier | modifier le code]
Les premières études sur l'action œstrogénique du bisphénol A datent des années 1930 où il fut administré à des rates ayant subi une ablation des ovaires. Une action en tant qu'androgène fut rapidement fortement suspectée[126]. Ces effets pourraient entraîner des problèmes de santé chez l'homme, tels qu'une diminution du taux ou de la qualité des spermatozoïdes. Le bisphénol A peut causer des anomalies de fonctionnement d'autres organes, comme le pancréas[127] ou la thyroïde[128].
L'industrie du plastique a longtemps affirmé que le bisphénol A était sans danger pour l'homme, minimisant ou réfutant les tests donnant des résultats contraires. Onze études effectuées par des industriels ne mettaient aucun risque en évidence tandis que, d'après un rapport de Frederick vom Saal et Claude Hughes, 90 % des 104 études indépendantes montrent un risque possible[68]. Un rapport rendu public par le Centre pour l'analyse des risques de l'Université Harvard[129] et financé par le Conseil américain du plastique[130] qualifiait le risque de « faible » et « non significatif ». Claude Hughes considère dans le rapport de 2004 que cette publication du Centre pour l'analyse des risques n'est pas fiable parce qu'elle ne prend en compte que peu de travaux publiés depuis 2001 sur l'effet des faibles doses de BPA sur la santé.
En 2005, l'équipe de S.M Belcher démontrait que de faibles taux de bisphénol A peuvent entraîner une altération du développement du fœtus chez le rat[131].
En 2006, vom Saal et Welshons[132] ont publié une analyse détaillée expliquant pourquoi certaines études, principalement menées par des laboratoires financés par l'industrie, n'obtenaient pas des résultats reproductibles sur les effets à faible dose du bisphénol A. Un comité scientifique indépendant a réanalysé les données du rapport pour le compte d'une agence du gouvernement américain et a montré qu'en réalité un effet existe en dépit des conclusions opposées du rapport originel[réf. nécessaire].
En 2008, Lang & al. détectent une corrélation entre le taux urinaire de bisphénol et le risque d'apparition de désordres cardiovasculaires[133] et un risque accru de diabète[133] et de certaines anomalies chez l'adulte (concentration anormales d'enzymes γ-glutamyltransferase dans le foie et de phosphatase alcaline)[133].
En 2009, Stahlhut et al. ont montré[134] que les taux urinaires de BPA d'hommes adultes ne diminuaient pas en période de jeûne. Ceci contredit la théorie qui veut que tout le BPA absorbé avec la nourriture soit rapidement métabolisé et virtuellement éliminé en moins de 24h chez l'humain adulte (hypothèse déduite de 3 études expérimentales chez l'homme avec exposition à des doses élevées de BPA, et alors que les études animales aboutissaient généralement aux mêmes conclusions selon Vandenberg et al. 2007[135]). Cette étude montre soit qu'il existe une voie d'exposition constante au BPA indépendante de l’alimentation, ou que cette molécule peut être accumulée dans des tissus tels que la graisse corporelle (qui est consommée durant le jeûne) plus longtemps qu'on ne le pensait ; ces deux hypothèses explicatives pouvant également coexister.
Depuis plusieurs décennies, le BPA était considéré comme rapidement métabolisé ou dégradé dans l'organisme humain ou animal ; la présence constante de BPA dans les tissus ou liquides du corps humain était donc supposée provenir d'une exposition continue à ce produit, principalement par l’alimentation supposait-on. Cette supposition est remise en question par les travaux de Stahlhut et ses collègues, qui laissent envisager l'hypothèse que certaines cellules pourraient être exposée en continu au BPA durant des périodes plus longues qu'on ne le pensait.
De 2009 à 2011, divers travaux scientifiques conduits au sein de l'INRA concluent (pour la première fois) que l’exposition au bisphénol A a des conséquences sur la fonction intestinale chez le rat : l’appareil digestif du rat se montre très sensible aux faibles doses de BPA, qui affecte la perméabilité intestinale[136], la douleur viscérale et la réponse immunitaire à l’inflammation digestive. Les effets du BPA sur l’intestin s'observent dès une dose dix fois inférieure à la dose journalière admissible pourtant considérée comme très sécuritaire pour l’homme. Cette étude montre également que l’exposition pré- et post-natale de ces animaux peut fragiliser la fonction de « barrière intestinale » à l’âge adulte[137] et avec des différences selon le sexe[69] et des variations de perméabilité selon la période du cycle sexuel chez la femelle du rat[138]. V. Braniste (2011) juge la propriété (diminution œstrogéno-dépendante du transport paracellulaire) alors méconnue des œstrogènes « intéressante à considérer dans les pathologies associées à une hyperperméabilité intestinale, telle que le Syndrome de l'intestin irritable ou les maladies inflammatoires chroniques de l'intestin (...) »[138].
Controverses ou limites des études toxicologiques[modifier | modifier le code]
L'industrie finance et fait publier un petit nombre d'études qui ne trouvent jamais rien afin de créer une controverse là où il n'y en a pas et ainsi de retarder les législations restrictives[139].
Il est difficile de trouver des toxicologues experts en matière de bisphénol sans risques de conflit d'intérêts[réf. nécessaire]. L'indépendance des experts siégeant au sein de l'Autorité européenne de sécurité des aliments chargée des recommandations en matière de santé publique est elle aussi mise en cause, 59 % de ses experts étant en conflit d'intérêts selon le rapport de la journaliste Stéphane Horel, auditionnée par l'Assemblée nationale française[140]. Pour certains, en préférant les études toxicologiques financées par l’industrie, réalisées suivant des protocoles vieux de 60 ans, aux résultats récents des recherches en endocrinologie, « Bruxelles a élaboré ses propres éléments de preuve pour éviter une réglementation trop stricte »[141]. La commission de l'Assemblée nationale préconise d'éviter que « Bruxelles fabrique une pseudo-science pilotée par l’industrie »[140].La représentativité du rat ou de certaines souches d'animaux de laboratoire en termes de sensibilité à certains perturbateurs hormonaux est discutée[réf. nécessaire].
Les évaluations basées sur plusieurs générations de rats (ou autres mammifères) exposées, ou sur le suivi d'une descendance non exposée, sont rares[réf. nécessaire]. Certains auteurs affirment que les études basées sur les rats sont biaisées : les auteurs d'une étude de l'université du Missouri affirment ainsi que les lignées de rats de laboratoire utilisées par les industriels pour les évaluations toxicologiques du bisphénol A sont au moins 25 000 fois moins sensibles aux perturbations hormonales que la moyenne[142].
La position des organismes officiels de sécurité sanitaire[modifier | modifier le code]
En 2006 l'Autorité européenne de sécurité des aliments (AESA) souligne, en conclusion d'un rapport sur le bisphénol A, sa présence dans les canalisations de transport de l'eau potable et dans divers contenants[143]. Elle préconise que soit étudiée une possible propagation de cette substance dans l'eau. De plus, l’AESA fixe alors à 0,05 mg·kg-1 (= 50 μg·kg-1) de poids corporel la dose journalière tolérable pour cette substance[144] (soit 2,5 mg maximum par jour pour une personne de 50 kg), taux alors retenu par l'Anses.
Le , un rapport de la Food and Drug Administration concluait que ce produit ne posait pas de problème de santé aux niveaux d'exposition habituels pour l'homme ; ce constat n'est pas partagé par de nombreux scientifiques, y compris au sein d'un groupe consultatif de la FDA qui accuse l'agence de ne retenir que les arguments avancés par les études financées par l'industrie du plastique et d'ignorer une centaine d'études[39], créant « un faux sentiment de sécurité », alors que d'autres rapports ou études alertent sur les risques liés à ce produit. L'agence s'est engagée à réétudier la question[145], ce qui l'a amené à renverser partiellement sa position : si elle n'a pas interdit le bisphénol A, ni contraint les producteurs à afficher la présence de bisphénol A sur les étiquettes (ce dernier étant classé « additif alimentaire ») faute, dit-elle, de preuves suffisantes, elle conseille le public de minimiser son exposition à ce produit[39]. Ayant lancé une enquête dotée d'un budget de 30 millions de dollars sur deux ans pour étudier le bisphénol[39], elle souligne que 90 % de la population américaine présente des traces de bisphénol dans son urine[39] et se déclare particulièrement soucieuse des effets du bisphénol sur les fœtus, les bébés et les jeunes enfants[39]. L'industrie du bisphénol produit plus de 6 millions de tonnes par an de ce produit[39].
Le 30 septembre 2010, l'Agence européenne de sécurité des aliments rend un avis concluant qu'il n'existe aucune nouvelle preuve les amenant à reconsidérer la DJA fixée à 0,05 mg kg−1 de poids corporel et considère qu'il n'est pas dangereux pour la santé[146], mais l'Anses en France considère que cette référence n'est plus fiable, la notion de seuil étant selon elle à préférer aux DJT (Doses journalières Tolérables)[71], et la DJT fixée par l'EFSA étant 600 fois supérieure à celle préconisée par l’ANSES[140].
En 2011, l'Anses a publié deux rapports : le premier sur les effets sanitaires du bisphénol A et le second sur ses usages[71], avant de lancer un appel à contributions, pour recueillir des commentaires sur le contenu et les pistes de ses travaux et pour recevoir toute donnée scientifique concernant, notamment, les produits de substitution disponibles ou des données relatives à leur innocuité et efficacité[147].
En 2013, l'Anses dans un nouveau rapport d'évaluation de la toxicité du bisphénol A[148] estime que l'essentiel du bisphénol A vient de l'alimentation, mais que des situations particulières existent (exposition aux tickets de caisse thermiques, bonbonnes à eau en polycarbonate), et qu'un effet sur les fœtus n'est pas exclu.
En janvier 2014, l'EFSA révise ses chiffres à la baisse, divisant par 10 la DJT ; la ramenant à 5 microgramme par kilogramme de poids corporel et par jour[140].
Recommandations des agences sanitaires[modifier | modifier le code]
- Le 5 février 2010, l'Agence française de sécurité sanitaire des aliments (AFSSA) rend un avis sur le bisphénol A[64]. L'AFSSA dit constater des « effets subtils » sur le comportement de jeunes rats exposés in utero, ce qui l'incite à « poursuivre son travail d'expertise pour comprendre ces signaux d'alertes ». C'est un avis insatisfaisant pour l'Association santé environnement France qui y voit « un symbole du grand écart entre les préoccupations quotidiennes des gens et les abstraites recommandations des agences de l'État »[149][réf. nécessaire].
- En avril 2010, l'AFSSA estime qu'il n'y a « pas de raison de modifier les habitudes alimentaires », mais que « la protection des consommateurs doit être renforcée, et le niveau d'exposition de la population réduit ». L'AFSSA se fonde sur 769 échantillons d'aliments et sodas analysés, ayant montré des teneurs variables, inférieures au seuil de détection jusqu'à 17 microgrammes par kilogramme (µg/kg) d'aliment voire atteignant 128 μg·kg-1 dans les conserves de légumes, poissons et plats cuisinés[150]. À la suite de ce travail, l'agence en appelle à une mobilisation de l'industrie […] pour mettre au point des substituts du BPA pour les usages alimentaires et à une réévaluation des limites de migration spécifique du BPA. L'AFSSA recommande également d'étiqueter les ustensiles alimentaires incorporant du bisphénol A[30].
- En septembre 2010, l'Autorité européenne de sécurité des aliments conclut qu'aucune nouvelle preuve ne peut à cette date conduire à reconsidérer la dose journalière tolérable (DJT) pour le bisphénol A, fixée en 2006 à 0,05 mg/kg de poids corporel[151].
- En 2011, l'Institut de veille sanitaire démontre que, présent dans certains instruments médicaux, le bisphénol A se transmet aux patients[31].
- A partir d'avril 2012, l'EFSA procède à une ré-étude du problème, avec consultation publique sur son projet d'avis scientifique (en juillet 2013[152]).
- Le 9 avril 2013, après trois ans de contributions d'une centaine de scientifiques, l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) rend un avis concluant à des risques potentiels pour la santé, et confirme la nécessité de réduire les expositions[153],[154]. En attendant, l'Agence recommande « un étiquetage systématique » invitant les consommateurs à ne pas chauffer les produits contenant du BPA trop longtemps, car « la présence de BPA dans les aliments est principalement due à sa migration à partir des matériaux au contact, ce phénomène étant accentué par le chauffage ».
Bisphénol A et biberons[modifier | modifier le code]
En 2008, le bisphénol A était très présent dans les plastiques alimentaires et notamment dans les polycarbonates, dans 90 % des biberons qui peuvent en relarguer des quantités significatives dans les aliments ainsi donnés aux bébés[155],[156]. Face aux risques médiatisés cette année, certains fabricants de biberons (Dodie ; Avent du groupe Philips) ont décidé la même année de fabriquer des biberons sans BPA mais commercialisés plus chers[157]. Ceux-ci ont également publié des questions/réponses sur leurs sites Internet pour rassurer les clients et leur donner leurs avis sur le bisphénol A et leurs recommandations d'utilisation des biberons actuels (notamment la « chauffe[158] »).
Le , le Canada est devenu le premier pays dans le monde à interdire les biberons contenant du bisphénol A[159]. La France les a interdit deux ans après, soit en 2010, dans le cadre du projet de loi Grenelle II.
En France, dans un communiqué du , l'Agence française de sécurité sanitaire des aliments (Afssa) s'est alignée sur les conclusions de l'Autorité européenne de sécurité des aliments (AESA) selon lesquelles l'exposition des nourrissons au bisphénol A est largement inférieure à la dose journalière tolérable (DJT) et ce, même en cas de chauffage au micro-ondes[160]. Quelques jours plus tard, le Canard enchaîné dénonçait un conflit d'intérêts en faisant remarquer que de nombreux membres du comité d'experts de l'Afssa étaient également employés par l'industrie du plastique[161].
Début 2009, la polémique s'étend. En France, le Réseau environnement santé (RES), qui regroupe associations, ONG et scientifiques, demande aussi « l'interdiction du BPA dans les plastiques alimentaires ». Aux États-Unis comme en France, un certain nombre de fabricants annoncent qu'ils proposent ou vont proposer des biberons « garantis sans bisphénol A[162] ».
Les endocrinologues constatent une augmentation des problèmes testiculaires chez les garçons, de l'obésité précoce (le biosphénol fait partie des composés « obésogènes »[163]) et une avancée de l'âge de puberté des filles (par exemple, selon une étude publiée en 2010, ayant porté sur 1 239 fillettes de trois régions des États-Unis, 15 % d'entre elles ont entamé leur puberté vers 7 ans, et 20 % avaient de premiers poils pubiens dès 8 ans, ce qui confirme des résultats danois montrant que la formation des seins est de plus en plus précoce (Thélarche précoce) chez les jeunes européennes[164]. Des variations ethniques ou régionales sont constatées, qui pourraient être liées à l'alimentation et éventuellement à l'exposition au bisphénol A ou à d'autres facteurs environnementaux[165].
Lors de son colloque annuel (10 juin 2009), la Société internationale d'endocrinologie a de nouveau alerté sur cette question (effet perturbateur endocrinien sur la reproduction, implications dans les cancers du sein et de la prostate, dans certaines pathologies cardio-vasculaires, de la thyroïde et l’obésité). Elle a appelé à réduire l’exposition de la population à ces molécules, au nom du principe de précaution. Elle a publié une « déclaration scientifique »[166],[167] dans la revue Endocrine Reviews. La déclaration juge le problème préoccupant, et appelle à renforcer la recherche.
Le 5 février 2010, l'Agence française de sécurité sanitaire des aliments a rendu son avis sur le bisphénol A[64]. L'Afssa dit « constater des « effets subtils » sur de jeunes rats, ce qui l'incite à poursuivre son travail d'expertise pour comprendre ces signaux d'alertes ». Elle conseille donc de ne pas « chauffer trop fort » les aliments ou biberons au micro-ondes. Une recommandation qui ne satisfait pas du tout les médecins de l'Association santé environnement France, qui disent ne pas savoir ce que « chauffer trop fort veut dire[168] ». Dans le doute, les médecins de l'association appellent à prendre quelques précautions simples, notamment préférer l'utilisation de biberons en verre incassable ou en plastique sans BPA.
En 2017 une revue des études (cliniques ou épidémiologiques) faites dans les 20 ans précédents, sur les liens éventuels entre exposition au BPA et âge de la puberté, n'a trouvé que 19 études sur le sujet[163]. Sept de ces études ont conclu à une corrélation, « dont chez les sujets présentant une puberté précoce centrale ou un développement prématuré isolé du sein (thélarche) de 2 mois à 4 ans, même si le mécanisme n'est pas défini »[163]. Plusieurs études ont trouvé une relation étroite entre le BPA urinaire et le risque d'obésité et de puberté précoce, mais le rôle du BPA n'est pas encore expliqué ; les résultats cliniques et épidémiologiques étant contradictoires[163]).
Méthodes analytiques[modifier | modifier le code]
Plusieurs méthodes de dosage de BPA dans l’eau existent.
Parmi ces méthodes, l’une des plus utilisées est la SPE/GC, SPE/LC avec différents types de détection comme l’UV et la fluorescence. Bien que donnant une bonne limite de détection, les désavantages de cette technique, tels que sa lenteur et sa grande consommation de solvant, ont entraîné la mise au point de plusieurs autres techniques.
La technique de la SPME espace de tête pour détecter le BPA dans l'eau est la plus utilisée actuellement. Elle se déroule comme suit : 5 ml d’échantillon sont prélevés et filtrés avec un filtre fibre de verre de 0,45 μm de diamètre. Cet échantillon est introduit dans une fiole de 20 ml contenant 20[Quoi ?] du NaCl 20 % (poids/volume). On ajoute ensuite 50 µL de méthanol contenant 4 mg·l-1 de BPA d4 comme étalon interne. On ajoute ensuite 200 µl d’anhydride acétique puis la fiole est immédiatement scellée. Après 5 minutes de dérivatisation, 100 μm d’une fibre de type PDMS sont introduits dans l’espace de tête pendant 30 minutes et à 100 °C avec une agitation de 500 tours par minute. Cette fibre adsorbe les analytes d’intérêt dans la phase gazeuse située au-dessus de la matrice. Ces analytes concentrés sont par la suite désorbés dans l’injecteur d'un chromatographe en phase gazeuse à 280 °C pendant 5 minutes[169].
La SPME espace de tête/LC/MS/MS a été appliquée par Santé Canada pour détecter le BPA dans l’eau en bouteille.
L’évaluation des risques sanitaires liés au bisphénol A est effectuée sur des matrices de plus en plus complexes telles que les matrices alimentaires. Pour ces dernières, les méthodes de prétraitement d’échantillons jouent un rôle crucial pour obtenir des analyses fiables. Pour répondre à cette demande, des prétraitements par extraction en phase solide[170] (SPE) utilisant la technologie des empreintes moléculaires en polymère[171] permettent une extraction sélective et efficace du bisphénol A dans ces matrices complexes. Plusieurs applications ont été développées pour de telles matrices[172] (lait infantile en poudre ou liquide, aliments en conserve…). Ainsi cette technologie est utilisée lors des analyses de l’ensemble des matrices alimentaires liquides et solides du rapport d’évaluation des risques sanitaires du BPA de l’ANSES[148] de mars 2013 (méthode décrite dans l’annexe 12 des Annexes du rapport[173]).
Réduire son exposition[modifier | modifier le code]
L'importance de la toxicité du bisphénol A, de ses substituts et d'autres composants du plastique est encore en discussion entre les scientifiques. Le principe de précaution suggère cependant de réduire l'exposition, en particulier des nourrissons et des femmes qui désirent avoir des enfants. Il est possible de réduire fortement son exposition en adoptant une alimentation variée à base de produits frais et en évitant la vaisselle et les conditionnements en plastiques[174].
Notes et références[modifier | modifier le code]
- BISPHENOL A, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 4,4'-Isopropylidenediphenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 juillet 2009 (JavaScript nécessaire)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 3, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-859-4)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Bisphénol A » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- AEPC (2017) MSC unanimously agrees that Bisphenol A is an endocrine disruptor ; The Member State Committee (MSC) supported the French proposal to additionally identify Bisphenol A as a substance of very high concern because of its endocrine disrupting properties which cause probable serious effects to human health. The committee also agreed to identify the substance PFHxS as an SVHC., Communiqué ECHA/PR/17/12
- Damien Coulomb (2017) L'agence européenne des produits chimiques classe le bisphénol A dans la catégorie des perturbateurs endocriniens, Le quotidien du médecin | 16.06.2017
- |EFSA (2016) Effets du bisphénol A sur le système immunitaire : de nouveaux éléments de preuve utiles mais limités, communiqué
- Stéphane Foucart, Le Monde, Les effets du bisphénol A sont transgénérationnels (chez la souris), brève du journal Le Monde, évoquant une étude à paraître dans la prochaine édition de la revue Endocrinology, 22 juin 2012
- Le Bisphénol A (BPA) et les biberons ?, article École Normale Supérieure - DGESCO.
- Inserm, Reproduction et environnement, Les éditions Inserm, Paris, 2011, Chapitre 29: Bisphénol A
- « Le concept de perturbation endocrinienne et la santé humaine », Médecine/sciences ; février 2007 ; vol. 23 ; no 2 ; Voir.
- Vidéo de la partie d'une séance du Conseil constitutionnel consacrée à l'Affaire n° 2015-480 QPC ; Interdiction du bisphénol A
- alerte aux biberons et au bisphénol A, InfosSante.com, 10 février 2009
- avec AFP et Reuters, « Le Parlement interdit l'utilisation des biberons au bisphénol A », Le Monde.fr, (lire en ligne)
- Texte de la loi 2010-729, sur Légifrance
- [PDF] Sénat de Belgique, Proposition de loi visant à interdire le bisphénol A dans les tickets de caisse et les reçus de carte de crédit (19 mai 2011)
- « Le bisphénol A dans les contenants alimentaires interdit en 2013 », RTBF Info, (lire en ligne, consulté le )
- Bisphénol A : le Sénat adopte l'interdiction dans les contenants alimentaires, Le Monde, 9 octobre 2012
- Vers une interdiction complète des conditionnements alimentaires contenant du bisphénol A, Espace Presse du Sénat, Consulté le 19 août 2017
- Texte de la loi 2012-1442 sur légifrance du 24 décembre 2012
- Les Sages déclarent inconstitutionnelle la loi qui a suspendu la fabrication et l'exportation des emballages alimentaires contenant du BPA. La suspension d'importation et de mise sur le marché est en revanche validée, publié 17 septembre 2015
- « Bisphénol A : toujours présent malgré son interdiction », France Info, (consulté le )
- [PDF] Réseau Environnement Santé, « Risques liés au bisphénol A - Articles parus d'avril à juin 2012 dans la littérature scientifique (Source PubMed) » (consulté le )
- (fr + en) [PDF] Réseau Environnement Santé, « Veille Internet BPA 9/05/2011 au 15/05/2011 - Bisphénol A (BPA) sur Internet (Faits marquants) » (consulté le )
- (en) Dominique Browning, « Hitting the Bottle », NY Times, (consulté le ).
- Jean-Charles Batenbaum, « Le bisphénol S remplace le bisphénol A », sur Actualisé news environnement, (consulté le ).
- « Où trouve-t-on encore du Bisphénol A ? », sur RTBF Tendance, (consulté le )
- Emeline Dufour, « Bisphénol A : l'Afssa préconise un étiquetage systématique », Doctissimo, (lire en ligne)
- Cécile Dumas, « Phtalates et bisphénol A : bébés et mamans exposés à l'hôpital », Sciences et Avenir, (lire en ligne)
- « Mauvais plan B », Le Canard Enchaîné, no 5236, .
- Le Nouvel Observateur, 25 septembre 2008.
- Polydorou O, König A, Hellwig E, Kümmerer K. Long-term release of monomers from modern dental-composite materials. Eur. J. Oral Sci., février 2009 ; 117(1):68-75.
- https://www.anses.fr/en/system/files/MCDA2007sa0312.pdf : Avis de l’Agence française de sécurité sanitaire des aliments relatifs à l’inertie et à l’innocuité chimique des Matériaux aux Contacts des Denrées Alimentaires (MCDA) issus des résines (exemple no 1)
- Gouvernement du Canada, Bisphénol A du deuxième lot du Défi
- Gouvernement du Canada, Substances chimiques du deuxième lot du Défi
- Environnement Canada et Santé Canada, Approche de gestion des risques proposée pour le Phénol, 4,4'-(1-méthyléthylidène) bis (Bisphénol A), octobre 2008
- Lyndsey Layton, Reversing itself, FDA expresses concerns over health risks from BPA, The Washington Post, 16 janvier 2010
- Communication de l'USDA sur le bisphénol A
- Bisphénol A: l'agence sanitaire admet pour la 1re fois des « signaux d'alerte », dépêche AFP du 5 février 2010
- [PDF] Journal officiel de l'Union européenne, Directive 2011/8/UE de la Commission du 28 janvier 2011, consulté le 20 mai 2013
- La revue Prescrire, mai 2013, 33, 315, p. 376
- INERIS, L’Europe renforce la classification du Bisphénol A, 1er décembre 2016
- INERIS, Le bisphénol A : une substance extrêmement préoccupante selon la Règlementation européenne REACH, 23 janvier 2017
- [PDF] Journal officiel de l'Union européenne Règlement 2016_2235, Nouveau règlement (UE) concernant l'utilisation du bisphénol A dans le papier thermique
- Directive (UE) 2020/2184 du Parlement européen et du Conseil du 16 décembre 2020 relative à la qualité des eaux destinées à la consommation humaine (refonte) (Texte présentant de l’intérêt pour l’EEE) (à transposer au plus tard le 12 janvier 2023), vol. OJ L, (lire en ligne)
- « Bisphénol A », sur Autorité européenne de sécurité des aliments, (consulté le ).
- Site du Sénat: nouvelle loi interdisant le bisphénol A
- Décision n° 2015-480 QPC du 17 septembre 2015 - Association Plastics Europe [Suspension de la fabrication, de l'importation, de l'exportation et de la mise sur le marché de tout conditionnement à vocation alimentaire contenant du Bisphénol A] et communiqué de presse du Conseil Constitutionnel Ref 2015-480 QPC
- Dominique Browning, « Hitting the Bottle », The New York Times, (lire en ligne)
- Conseil de l'Europe, Résolution-cadre ResAP(2004)1 sur les vernis destinés à entrer en contact avec des denrées alimentaires
- « Eden Foods - Eden Foods Bisphenol-A (BPA) Free Pioneer », sur www.edenfoods.com (consulté le )
- Melody Voith, « Can Conundrum | Business | Chemical & Engineering News », sur pubs.acs.org (consulté le )
- « FAQ: BPA and Alternatives », sur www.breastcancerfund.org (consulté le )
- Lamprea K, Mirande-Bret C, Bressy A, Caupos E & Gromaire M.C (2017). Évaluation du potentiel d’émission d’alkylphénols et de bisphénol A par lessivage des matériaux de construction, des pièces et des consommables automobiles. Techniques Sciences Méthodes (7-8), 71-90.
- Ellero S (2010) Conséquences moléculaires de l'exposition du tissu adipeux humain à des xénobiotiques environnementaux, Thèse de toxicologie, AgroParisTech. Voir p 75/256
- Calafat A.M., Kuklenyik Z., Reidy J.A. et al., Urinary concentrations of bisphenol A and 4-nonylphenol in a human reference population, Environ. Health Perspect., 2005 ; 113 : 391-5.
- Becker K., Göen T., Seiwert M., Conrad A., Pick-Fuß H., Müller J., Wittassek M., Schulz C., Kolossa-Gehring M.(2009). GerES IV: Phthalate metabolites and bisphenol A in urine of German children, Int. J. Hyg. Environ. Health 212: 685–692.
- Geens T. et al., A review of dietary and non-dietary exposure to bisphenol-A, Food and Chemical Toxicology, 2012 ; 50: 3725–3740.
- Article Scientific America, 2008
- Agence nationale de sécurité sanitaire, environnement, travail, Évaluation des risques du bisphénol A (BPA) pour la santé humaine, Tome 2, Annexes, mars 2013.
- Agence française de sécurité sanitaire des aliments, Avis de l’Agence française de sécurité sanitaire des aliments relatif à l’analyse critique des résultats d’une étude de toxicité sur le développement du système nerveux ainsi que d’autres données publiées récemment sur les effets toxiques du bisphénol A, document MCDA2009sa0270, 29 janvier 2010.
- Biedermann S, Tschudin P, Grob K. (2010), Transfer of bisphenol A from thermal printer paper to the skin. Anal Bioanal Chem ;398(1):571-576.
- Zalko D, Jacques C, Duplan H, Bruel S, Perdu E. (2010) Viable skin efficiently absorbs and metabolizes bisphenol A. Chemosphere
- Le Bisphénol A pénétrerait l’organisme par la peau
- vom Saal FS, Hughes C. An extensive new literature concerning low-dose effects of bisphenol A shows the need for a new risk assessment, Environ. Health Perspect., 2005;113:926-33.
- V. Braniste, A. Jouault, E. Gaultier, A. Polizzi, C. Buisson-Brenac, M. Leveque, P.G. Martin, V. Theodorou, J. Fioramonti, E. Houdeau, « Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats », PNAS, vol. 107, no 1, , p. 448-53 (lire en ligne)
- Sun Young Park et Jinhee Choi, Cytotoxicity, genotoxicity and ecotoxicity assay using human cell and environmental species for the screening of the risk from pollutant exposure Environment International vol. 33, issue 6, 2007, p. 817-822.
- Effets sanitaires du bisphénol A - Connaissances relatives aux usages du bisphénol A sur www.anses.fr, septembre 2011, 311 p. et 68 p.
- Beronius A., Ruden C., Hakansson H., Hanberg A., (2009). Risk to all or none? A comparative analysis in the health risk assessment of bisphenol A, Reprod. Toxicol., accepted manuscript, doi:10.1016/j.reprotox.2009.11.007.
- American Chemistry Council (2009). DNT study: A dietary developmental neurotoxicity study of bisphenol in rats, WIL- 186056, septembre 2009, 4796 p.
- Aydogan M., Korkmaz A., Barlas N., Kolankaya D., (2009) Pro-oxidant effect of vitamin C coadministration with bisphenol A, nonylphenol, and octylphenol on the reproductive tract of male rats. Drug Chem. Toxicol. 1-11. doi:10.3109/01480540903286468
- « L'effet nocif du Bisphénol A sur la santé démontré », Challenges.fr, (lire en ligne)
- Bisphénol A: l'EFSA organise une consultation publique sur l'évaluation des risques pour la santé humaine, EFSA, 17 janvier 2014
- « metronews.fr/info/bisphenol-a-… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- http://www.anses.fr/fr/content/bisph%C3%A9nol
- avec AFP, « L'interdiction du bisphénol A dans les contenants alimentaires définitivement adoptée », Le Monde.fr, (lire en ligne)
- Rouillon, S., Grignon, C., Venisse, N., Nadeau, C., Albouy-Llaty, M., Migeot, V., ... & Brunet, B. (2015) Exposition hydrique au bisphénol A et à ses dérivés chlorés et liens avec le cancer du sein: étude de faisabilité BREDI I (Breast and Endocrine Disrupter Investigation Part 1). Revue des sciences de l’eau/Journal of Water Science, 28(3), 215-220
- DUPUIS A., V. MIGEOT, A. CARIOT, M. ALBOUY-LLATY, B. LEGUBE et S. RABOUAN (2012). Quantification of bisphenol A, 353-nonylphenol and their chlorinated derivatives in drinking water treatment plants. Environ. Sci. Pollut. Res. Int., 19, 4193-4205.
- FAN Z., J. HU, W. AN et M. YANG (2013). Detection and occurrence of chlorinated byproducts of bisphenol A, nonylphenol, and estrogens in drinking water of China: Comparison to the parent compounds. Environ. Sci. Technol., 47, 10841-10850.
- Liao C & Kannan k (2012) Determination of free and conjugated forms of bisphenol A in human urine and serum by liquid chromatography-tandem mass spectrometry. Environ. Sci. Technol., 46, 5003-5009.
- FERNANDEZ M.F., J.P. ARREBOLA, J. TAOUFIKI, A. NAVALON, O. BALLESTEROS, R. PULGAR, J.L. VILCHEZ et N. OLEA (2007). Bisphenol A and chlorinated derivatives in adipose tissue of women. Reproductive Toxicol., 24, 259-264.
- Ning G, Bi Y, Wang T et al., Relationship of urinary bisphenol A concentration to risk for prevalent type 2 diabetes in chinese adults: A cross-sectional analysis, Ann. Intern. Med., 2011:155:368-374
- Melzer D, Rice NE, Lewis C, Henley WE, Galloway TS, 2010, Association of Urinary Bisphenol A Concentration with Heart Disease: Evidence from NHANES 2003/06, PLoS ONE 5(1): e8673. doi:10.1371/journal.pone.0008673
- Lang IA, Galloway TS, Scarlett A et al., Association of urinary bisphenol A concentration with medical disorders and laboratory abnormalities in adults, JAMA, 2008;300:1303-1310.
- Are Causal Associations in Epidemiological Studies of BPA Exposure Plausible ? Saturday, February 16, 2013Room 302 (Hynes Convention Center) Richard M. Sharpe, University of Edinburgh, Edinburgh, United Kingdom http://aaas.confex.com/aaas/2013/webprogram/Paper8733.html
- Katia Jedeon, Muriel De la Dure-Molla, Steven J. Brookes, Sophia Loiodice, Clémence Marciano, Jennifer Kirkham, Marie-Chantal Canivenc-Lavier, Sofiane Boudalia, Raymond Bergès, Hidemitsu Harada, Ariane Berdal, Sylvie Babajkoemail (2013), Enamel Defects Reflect Perinatal Exposure to Bisphenol A, en ligne le 12 juin 2013, doi:10.1016/j.ajpath.2013.04.004 (résumé)
- INSERM (2013), Les dents seraient-elles les nouvelles victimes du Bisphénol A ? Oui, selon les conclusions des travaux de l'équipe de chercheurs dirigés par Ariane Berdal de l’Université Paris-Diderot et Sylvie Babajko, directrice de recherche Inserm au sein de l’Unité Inserm 872 "Centre des cordeliers" ; 11 juin 2013, d'après une étude publiée dans l'American Journal of Pathology. (communiqué, sur inserm.fr)
- à comparer aux 0.5 à 40 nM couramment trouvées dans le lait maternel et le sang
- Barrett J.R (2009) Trumped Treatment ? : BPA Blocks Effects of Breast Cancer Chemotherapy Drugs. Environmental health perspectives, 117(2), A75. (résumé)
- Beronius A., Ruden C., Hanberg A., Hakansson H., (2009). Health risk assessment procedures of endocrine disrupting compounds within different regulatory frameworks in the European Union, Regul. Toxicol. Pharmacol. 55(2):111-22.
- Peretz J, Vrooman L, Ricke WA, Hunt PA, Ehrlich S, Hauser R, Padmanabhan V, Taylor HS, Swan SH, VandeVoort CA, et al. (2014), Bisphenol a and reproductive health : update of experimental and human evidence, 2007-2013 ; Environ Health Perspect. Aout 2014 ; 122(8):775-86. Epub 4 juin 2014 (résumé).
- DG Moon, HS Park, JB Choi, YS Kim, JJ Kim, Bisphenol a inhibits penile erection via alteration of penile histology in the rabbit Department of Urology, Korea University, Séoul, Corée ([PDF] Résumé / Voir p. 33/39 § P5/6 - 128) 3 groupes de lapins de laboratoire mâles (un 4e groupe servant de témoin) ont été exposés durant 8 semaines à 3 doses différentes de bisphénol A ; 1 μg·kg-1, 1 ng·kg-1 et 1 pg·kg-1. Les échantillons de tissu caverneux du pénis ont été récoltés pour les études pharmacologiques et histologiques. Dans tous les groupes traités, le tissu caverneux ne réagissait pas normalement aux tests par rapport aux témoins (p <0,01) et ce d'une manière dépendante de la dose. Le BPA a entraîné la dysfonction érectile par altération du pénis, même à une dose de l'ordre du picogramme.
- Markey CM, Luque EH, Munoz de Toro MM et al., « In utero exposure to bisphenol A alters the development and tissue organization of the mouse mammary gland ». Biol. Reprod. 2001 ; 65 : 1215-23.
- Timms BG, Howdeshell KL, Barton L et al., « Œstrogenic chemicals in plastic and oral contraceptives disrupt development of the fetal mouse prostate and urethra ». Proc. Natl. Acad. Sci. États-Unis 2005 ; 102 : 7014-9.
- Chitra KC, Latchoumycandane C, Mathur PP. Induction of oxidative stress by bisphenol A in the epididymal sperm of rats. Toxicology. 2003 Mar 14;185(1-2):119-127
- Herath CB, Jin W, Watanabe G, Arai K, Suzuki AK, Taya K. Adverse effects of environmental toxicants, octylphenol and bisphenol A, on male reproductive functions in pubertal rats. Endocrine 2004 Nov ; 25(2):163- 172.
- Mok-Lin E, Ehrlich S, Williams P., Petrozza J, Wright DL, Calafat AM, Ye X, Hauser R. Urinary bisphenol A concentrations and ovarian response among women undergoing IVF. Int J Andro. 2010 Apr; 33(2):385-393
- Fujimoto VY, Kim D, vom Saal FS, Lamb JD, Taylor JA, Bloom MS, Serum unconjugated bisphenol A concentrations in women may adversely influence oocyte quality during in vitro fertilization Fertil Steril, avril 2011 ; 95(5):1816-9.
- Stump DG, Beck MJ, Radovsky A, Garman RH, Freshwater LL, Sheets LP, Marty MS, Waechter JM, Jr., Dimond SS, Van Miller JP, Shiotsuka RN, Beyer D, Chappelle AH, Hentges SG (2010) Developmentalneurotoxicity study of dietary bisphenol A in Sprague-Dawley rats. Toxicol. Sci. 115, 167-182
- Cox KH, Gatewood JD, Howeth C, Rissman EF (2010), Gestational exposure to bisphenol A and crossfostering affect behaviors in juvenile mice, Hormones and Behavior 58, 754-761. Et aussi : Poimenova et al., 2010
- Tian YH, Baek JH, Lee SY, Jang CG (2010) Prenatal and postnatal exposure to bisphenol a induces anxiolytic behaviors and cognitive deficits in mice. Synapse 64, 432-439
- catégorie B : solid-based indication for contact allergenic effects because of less frequency proven contact allergenic effet in humans taking into account existing positive animal data (Schlede et al., 2003).
- Prins GS, Birch L, Tang WY, Ho SM. (2007) Developmental estrogen exposures predispose to prostate carcinogenesis with aging Reprod Toxicol. Avril-mai 2007 ; 23(3):374-82. Epub 2006 Oct 24.
- GS, Tang WY, Belmonte J & Ho SM (2008) Perinatalexposure to oestradiol and bisphenol A alters the prostate epigenome and increases susceptibility to carcinogenesis. Prins Basic Clin Pharmacol Toxicol. 2008 Feb; 102(2):134-8 (résumé)
- Tarapore P, Ying J, Ouyang B, Burke B, Bracken B & Ho SM. (2014) Exposure to bisphenol A correlates with early-onset prostate cancer and promotes centrosome amplification and anchorage-independent growth in vitro ; PLoS One. Mar 3;9(3):e90332. doi:10.1371/journal.pone.0090332. eCollection 2014 (résumé)
- Prins GS, Hu WY, Shi GB, Hu DP, Majumdar S, Li G, Huang K, Nelles JL, Ho SM, Walker CL, Kajdacsy-Balla A, van Breemen RB, « Bisphenol A promotes human prostate stem-progenitor cell self-renewal and increases in vivo carcinogenesis in human prostate epithelium », Endocrinology, vol. 155, no 3, , p. 805-17 (PMID 24424067, DOI 10.1210/en.2013-1955, lire en ligne)
- Prins GS, Ye SH, Birch L, Ho SM, Kannan K. (2011) Serum bisphenol A pharmacokinetics and prostate neoplastic responses following oral and subcutaneous exposures in neonatal Sprague-Dawley rats ; Reprod Toxicol. 2011 Jan; 31(1):1-9. Epub 2010 Oct 8.
- Tyl RW, Myers CB, Marr MC, Thomas BF, Keimowitz AR, Brine DR, Veselica MM, Fail PA, Chang TY, Seely JC, Joiner RL, Butala JH, Dimond SS, Cagen SZ, Shiotsuka RN, Stropp GD, Waechter JM (2002), Threegeneration reproductive toxicity study of dietary bisphenol A in CD Sprague-Dawley rats. Toxicological Sciences 68, 121-146.
- Tyl RW, Myers CB, Marr MC, Sloan CS, Castillo NP, Veselica MM, Seely JC, Dimond SS, Van Miller JP, Shiotsuka RN, Beyer D, Hentges SG, Waechter JM (2008) Two-generation reproductive toxicity study of dietary bisphenol a in CD-1 (Swiss) mice. Toxicological Sciences 104, 362-384.
- Chitra et al., 2003, Herath et al., 2004
- Nagel et al., 1997
- Singh S, Li SS (2012), Epigenetic effects of environmental chemicals bisphenol A and phthalates. Int J Mol Sci. ; 13(8):10143-53. Epub 2012 Aug 15.
- Tang WY, Morey LM, Cheung YY, Birch L, Prins GS, Ho SM. (2012 ), Neonatalexposure to estradiol/bisphenol A alters promoter methylation and expression of Nsbp1 and Hpcal1 genes and transcriptional programs of Dnmt3a/b and Mbd2/4 in the rat prostate gland throughout life Endocrinology. Jan; 153(1):42-55. Epub 2011 Nov 22 (résumé).
- Perinatal bisphenol A exposure promotes dose-dependent alterations of the mouse methylome ; BMC Genomics. 2014 Jan 17;15:30. doi: 10.1186/1471-2164-15-30. . Kim JH, Sartor MA, Rozek LS, Faulk C, Anderson OS, Jones TR, Nahar MS, Dolinoy DC1 (résumé).
- JM Lobaccaro et A Trousson (2014) Environmental estrogen exposure during fetal life: a time bomb for prostate cancer. Endocrinology. 2014 Mar; 155(3):656-8
- Zalko D., Soto A.M., Dolo L. et al., « Biotransformations of bisphenol A in a mammalian model: answers and new questions raised by low-dose metabolic fate studies in pregnant CD1 mice ». Environ. Health Perspect. 2003 ; 111 : 309-19.
- Yves Miserey, « Le bisphénol A augmente le poids de naissance des bébés », Le Figaro.fr, (lire en ligne)
- INSERM, Reproduction et environnement - Une expertise collective de l’Inserm, 14 avril 2011
- BFR, 29 juillet 2010, BisphenolA : Studies (Stump et al. (2010) et Ryan et al. (2010)) provideno indications for adverse effects on neurological development and behaviour (BfR Opinion no 035/2010 du 29 juillet 2010)
- Mendonca, K., Hauser, R., Calafat, A. M., Arbuckle, T. E., & Duty, S. M. (2014) Bisphenol A concentrations in maternal breast milk and infant urine ; International archives of occupational and environmental health, 87(1), 13-20
- Kim, S., Lee, J., Park, J., Kim, H. J., Cho, G., Kim, G. H., ... & Choi, K. (2015). Concentrations of phthalate metabolites in breast milk in Korea: Estimating exposure to phthalates and potential risks among breast-fed infants. Science of The Total Environment, 508, 13-19.
- Kim, S., Park, J., Kim, H. J., Lee, J. J., Choi, G., Choi, S., ... & Choi, K. (2015). Association between Several Persistent Organic Pollutants in Serum and Adipokine Levels in Breast Milk among Lactating Women of Korea. Environmental science & technology, 49(13), 8033-8040.
- Takeuchi T, Tsutsumi O, Ikezuki Y, Takai Y, Taketani Y, Positive relationship between androgen and the endocrine disruptor, bisphenol A, in normal women and women with ovarian dysfunction, Endocr J, 2004;51:165-169.
- Ropero AB, Alonso-Magdalena P, Garcia-Garcia E, Ripoll C, Fuentes E, Nadal A, Bisphenol-A disruption of the endocrine pancreas and blood glucose homeostasis, Int. J. Androl., 2008 ; 31(2):194-200.
- Moriyama K., Tagami T., Akamizu T. et al., Thyroid hormone action is disrupted by bisphenol A as an antagonist, J. Clin. Endocrinol. Metab., 2002;87:5185-5190.
- Gray GM et al.. Weight of the Evidence Evaluation of Low-Dose Reproductive and Developmental Effects of Bisphenol A, Human and Ecological Risk Assessment, 2004; 10(5):875-921.
- American Plastics Council
- Le HH, Carlson EM, Chua JP, Belcher SM. Bisphenol A is released from polycarbonate drinking bottles and mimics the neurotoxic actions of estrogen in developing cerebellar neurons. Toxicol Lett. 2008 Jan 30;176(2):149-56.
- vom Saal FS, Welshons W, Large effects from small exposures. II. The importance of positive controls in low-dose research on bisphenol A, Environmental Research, 2006 Jan, 100: 50-76.
- Lang, I. A., Galloway, T. S., Scarlett, A., Henley, W. E., Depledge, M., Wallace, R. B., & Melzer, D. (2008). Association of urinary bisphenol A concentration with medical disorders and laboratory abnormalities in adults. Jama, 300(11), 1303-1310
- Stahlhut R.W, Welshons W.V & Swan S.H (2009) Bisphenol A data in NHANES suggest longer than expected half-life, substantial nonfood exposure, or both Biomedical Sciences publications (MU) (résumé).
- Vandenberg L.N, Hauser R, Marcus M, Olea N & Welshons W.V (2007) Human exposure to bisphenol A (BPA). Reproductive toxicology, 24(2), 139-177 (résumé).
- V. Braniste, M. Leveque, C. Buisson-Brenac, L. Bueno, J. Fioramonti, E. Houdeau (2009 ) “Oestradiol decreases paracellular permeability in the female rat colon through occludin up-regulation and oestrogen receptor β in epithelial cells.” J Physiol. ; 587:3317-28
- (en) V. Branistea et al., « Impact of oral Bisphenol A at reference doses on intestinal barrier function and sex differences after perinatalexposure in rats », PNAS, vol. 106, no 50, (résumé).
- Braniste V (2011), La barrière intestinale, une nouvelle cible des œstrogènes et des xénoestrogènes : le cas du Bisphénol A (thèse de doctorat/ euro-gastroentérologie et nutrition), Université Toulouse III-Paul Sabatier, PDF, 179pp.
- Stéphane Foucart, « Bisphénol A, les dessous d'un scandale sanitaire », Le Monde.fr, (ISSN 1950-6244, lire en ligne, consulté le )
- Rapport d'information déposé par la Commission des affaires européennes sur la stratégie européenne en matière de perturbateurs endocriniens - section « Les oppositions dans la sphère scientifique », sur le site assemblee-nationale.fr, 25 février 2014
- Stéphane Horel, « Perturbateurs endocriniens : la fabrique d’un mensonge », Le Monde.fr, (ISSN 1950-6244, lire en ligne, consulté le )
- Judith Duportail, Les tests sur les rats remis en cause après l'affaire Séralini, Le Figaro, rubrique Science, 2012-10-24, consulté 2012-10-28
- Avis du groupe scientifique sur les additifs alimentaires, les arômes, les auxiliaires technologiques et les matériaux en contact avec les aliments [AFC] relative au 2,2-bis(4-hydroxyphényl)propane (bisphénol A), http://www.efsa.europa.eu/fr/efsajournal/pub/428.htm
- Point sur le bisphénol A, voir aussi le dossier sur le BPA.
- A false sense of security, Chicago Tribune, 24 janvier 2009
- « Le bisphénol A n'est pas dangereux pour la santé, selon l'Agence européenne », Le Monde.fr, (lire en ligne)
- Voir § Appel à projet ; Rapports relatifs aux effets sanitaires et aux usages du bisphénol A sur www.anses.fr
- Évaluation des risques du bisphénol A (BPA) pour la santé humaine - Tome 1 sur www.anses.fr, mars 2013, 13 p. et 282 p.
- Voir leur positionnement de médecins de terrain
- Source : Marc Mortureux, directeur général de l'Afssa, lors d'un point sur l'évaluation en cours de l'exposition des consommateurs au bisphénol A.
- L’EFSA met à jour ses conseils concernant le bisphénol A, communiqué de presse du 30 septembre 2010
- EFSA, Bisphénol A: l'EFSA organisera une consultation publique sur son projet d'avis scientifique, 26 mars 2013, consulté le 14 mai 2013
- Paul Benkimoun et Stéphane Foucart, « Bisphénol A et cancer : les preuves s'accumulent », Le Monde, (lire en ligne)
- Bisphénol A: l’Anses met en évidence des risques potentiels pour la santé et confirme la nécessité de réduire les expositions sur www.anses.fr, 9 avril 2013
- Biedermann-Brem S., Grob K., Fjeldal P., (2008). Release of bisphenol A from polycarbonate baby bottles: mechanisms of formation and investigation of worst case scenarios. Eur. Food Res. Technol. 227: 1053-1060
- Biedermann-Brem S. et Grob K., (2009). Release of bisphenol A from polycarbonate baby bottles: water hardness as the most relevant factor, Eur. Food Res. Technol. 228: 679-684.
- « Allo, maman bobo ! », dans Le Nouvel Observateur, 25 septembre 2008 et Nouvel Observateur Magazine digital sur nouvelobs.com.
- Q/A Dodie et Q/A Avent.
- Sandrine Blanchard, « Seul le Canada s'inquiète des biberons au bisphénol A », Le Monde, (lire en ligne).
- Sandrine Blanchard, « Biberon chauffé au micro-ondes : pas de danger, assure l'Afssa », Le Monde, (lire en ligne).
- « Un biberon pour la route », Le Canard enchaîné, (lire en ligne).
- Pascale Santi, « Les biberons seront bientôt garantis sans bisphénol A », Le Monde, (lire en ligne)
- Leonardi, A.; Cofini, M.; Rigante, D.; Lucchetti, L.; Cipolla, C.; Penta, L.; Esposito, S (2017). The Effect of Bisphenol A on Puberty: A Critical Review of the Medical Literature. Int. J. Environ. Res. Public Health 2017, 14, 1044.
- Lise Aksglaede, Kaspar Sørensen, Jørgen H. Petersen, Niels E. Skakkebæk et Anders Juul, Recent Decline in Age at Breast Development: The Copenhagen Puberty Study Pediatrics, mai 2009 ; 123 : e932 - e939 (Résumé)
- Germaine M. Buck Louis, L. Earl Gray, Jr, Michele Marcus, Sergio R. Ojeda, Ora H. Pescovitz, Selma Feldman Witchel, Wolfgang Sippell, David H. Abbott, Ana Soto, Rochelle W. Tyl, Jean-Pierre Bourguignon, Niels E. Skakkebaek, Shanna H. Swan, Mari S. Golub, Martin Wabitsch, Jorma Toppari et Susan Y. Euling, Environmental Factors and Puberty Timing: Expert Panel Research Needs Pediatrics, février 2008 ; 121 : S192 - S207 (Résumé)
- (en) Diamanti-Kandarakis et al. ; « Endocrine-Disrupting Chemicals: An Endocrine Society Scientific Statement » ; Endocrine Reviews vol. 30, no 4, p. 293-342 (juin 2009) ([PDF] Déclaration, en anglais, 56 p., consulté le 17 juin 2009)
- (en) Résumé de l'étude EDRV
- http://www.lepost.fr/article/2010/02/05/1925498_l-avis-des-medecins-de-terrain-sur-l-avis-de-l-ultra-theorique-afssa-sur-le-bisphenol-a.html
- Intissar Limam, Ang line Guenne, Mohamed Ridha Driss et Laurent Mazeas, Simultaneous determination of phenol, methylphenols, chlorophenols and bisphenol-A by headspace solid-phase microextraction-gas chromatography-mass spectrometry in water samples and industrial effluents, Anal. Chem., vol. 90, issue 3, 6 janvier 2010, p. 230-244.
- Extraction en phase solide sur www.polyintell.fr
- Les polymères à empreintes moléculaires sur www.polyintell.fr
- Extraction spécifique du Bisphénol A dans de nombreuses matrices: eau, lait, bière ou conserves alimentaires sur www.polyintell.fr
- Annexe 12 : Méthode de mesure quantitative du BPA dans les matrices alimentaires sur www.anses.fr, mars 2013, p. 132-135
- La revue Prescrire, mai 2013, 33;35, p. 376
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Dianin, Zhurnal russkogo fiziko-khimicheskogo obshchestva, 23 (1891), p. 492 ff.
- Th. Zincke, Mittheilungen aus dem chemischen Laboratorium der Universität Marburg, Justus Liebigs Annalen der Chemie, 343 (1905), p. 75-131.
- (en) Handbook of Chemistry and Physics, CRC Press, 76e éd. (1995-1996).
- (en) E. C. Dodds et Wilfrid Lawson, « Synthetic strogenic Agents without the Phenanthrene Nucleus », Nature, vol. 137, p. 996 (1936).
- (en) E. C. Dodds et W. Lawson, « Molecular Structure in Relation to Oestrogenic Activity. Compounds without a Phenanthrene Nucleus », Proceedings of the Royal Society of London, séries B, Biological Sciences, vol. 125, p. 222-232 (1938).
- (en) Attila Zsarnovszky, Hoa H. Le, Hong-Sheng Wang et Scott M. Belcher, « Ontogeny of Rapid Estrogen-Mediated Extracellular Signal-Regulated Kinase Signaling in the Rat Cerebellar Cortex: Potent Nongenomic Agonist and Endocrine Disrupting Activity of the Xenoestrogen Bisphenol A », Endocrinology, no 146, p. 5388-5396 (2005).
- Jean-Yves Nau, « Alerte sanitaire sur les plastiques alimentaires », Le Monde, 14 mai 2008.
- Mansilha C, Silva P, Rocha S, Gameiro P, Domingues V, Pinho C, Ferreira IM () Bisphenol A migration from plastic materials: direct insight of ecotoxicity in Daphnia magna ; Environ Sci Pollut Res Int. 2013 Sep;20(9):6007-18. doi: 10.1007/s11356-013-1614-0. Epub 2013 Mar 22 ; (résumé)
- Stéphane Foucart, « Bisphénol A, les dessous d'un scandale sanitaire », Le Monde, 29 octobre 2011, p. 6-7.
- Barrett JR (2014) BPA and reproductive health reviewing the current state of the science. Environ Health Perspect. 2014 Aug;122(8):A223.
Articles connexes[modifier | modifier le code]
- Bisphénol
- Époxyde • Polyépoxyde • Polycarbonate
- Matière plastique
- Biberon • Jouet
- Perturbateur endocrinien
- Délétion de la spermatogenèse
- Syndrome de dysgénésie testiculaire
- Canalisation
Liens externes[modifier | modifier le code]
- Le Bisphénol A et les biberons, article scientifique École Normale Supérieure - DGESCO
- (en) ChemSub Online : Bisphénol A.
- Anti-BPA
- Pro-BPA
- Site d'information de l'industrie européenne du plastique sur le bisphénol A
- (en) Site d'information de l'industrie du plastique sur le bisphénol A
- Dossiers à vocation scientifique








